美国食品药品监督管理局 (FDA) 批准了 Symvess,这是第一个用于成人的无细胞组织工程血管,当需要紧急血运重建(恢复血流)以避免迫在眉睫的肢体丧失时,作为肢体动脉损伤的血管导管,并且自体静脉移植不可行。
当血管受伤时,就会发生血管创伤,例如四肢动脉破裂,这可能导致严重的、危及生命的并发症,例如出血或血液凝固。当肢体动脉发生损伤时,需要紧急手术修复以恢复正常血流。目前对肢体血管损伤患者的护理标准可能包括自体静脉移植术(使用患者自身血管进行手术修复)或植入合成移植物等手术。这些治疗并不适合或适合每位患者。
“今天的批准为血管创伤个体提供了一个重要的额外治疗选择,使用先进的组织工程技术生产,”FDA 生物制品评估和研究中心 (CBER) 主任 Peter Marks 医学博士说。“FDA 仍然致力于促进创新产品的开发,为严重受伤的患者提供可能挽救生命的好处。”
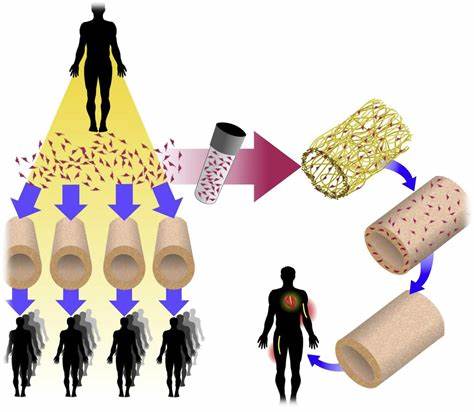
Symvess 是一种无菌、脱细胞的组织工程血管,由通常存在于人体血管中的人细胞外基质 (ECM) 蛋白组成。它是使用组织工程工艺制造的,利用源自人主动脉组织的人血管平滑肌细胞。Symvess 是一种一次性、一次性使用的产品,通过手术植入,用于替换患者在肢体外伤后受损的血管。
“目前可用的血管创伤治疗方案有限,这可能导致严重且可能危及生命的并发症,”CBER 治疗产品办公室主任 Nicole Verdun 医学博士说。今天批准一种基于新型医疗技术的新型治疗产品的决定,代表了在解决重大未满足的医疗需求方面取得的重要进展。
Symvess 的安全性和有效性是根据一项针对危及生命或肢体的血管创伤患者的前瞻性、单臂、多中心研究的数据评估的。共有 54 例患者接受了 Symvess 修复肢体动脉血管。根据植入后 30 天的一期通畅性 (在没有任何干预的情况下存在血流) 和二期通畅 (至少需要一种干预来维持血流) 评估疗效。在接受评估的 54 例患者中,36 例 (67%) 在第 30 天保留一期通畅,39 例 (72%) 保留二期通畅。5 例患者 (9%) 在前 30 天内接受了治疗肢体的截肢手术,8 例 (15%) 患者在研究结束(第 36 个月)前接受了治疗肢体的截肢手术。
Symvess 最常见的不良反应是血栓形成(Symvess 中的血凝块)、发烧、疼痛、吻合口狭窄(Symvess 缝合到患者血管的地方异常狭窄)。Symvess 的严重风险包括移植物破裂、吻合口失败和血栓形成。由于 Symvess 使用来自人类供体的细胞以及人和牛(牛)来源的试剂,因此可能会发生传染病或传染源的传播。用于生产 Symvess 的细胞来自符合预防传染性疾病的供体资格要求的供体。
该申请获得了优先审查、再生医学先进疗法 (RMAT) 称号,并被美国国防部 (DoD) 指定为优先产品。公法 115-92 授权国防部请求并授权 FDA 提供协助,以加快产品开发和 FDA 对产品的审查,以诊断、治疗或预防美国军事人员面临的严重或危及生命的疾病或病症。
FDA 将Symvess的批准授予Humacyte Global, Inc.。