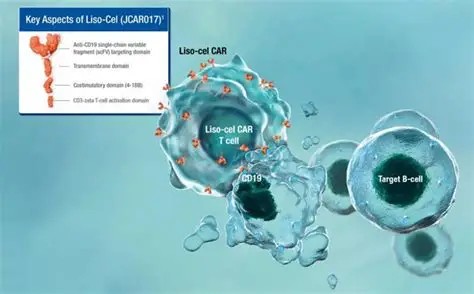
美国食品药品监督管理局(FDA)12月4日批准了Breyanzi(Lisocabtagene maraleucel)的新适应症,将其作为全美首个治疗既往接受过两线或以上治疗后治疗失败或复发的成人边缘区淋巴瘤(MZL)患者的CAR T细胞疗法。Breyanzi是一种嵌合抗原受体T细胞疗法,通过对患者自身的T细胞进行基因改造,使其能够靶向并杀死癌细胞。
美国食品药品监督管理局生物制品评价与研究中心(CBER)首席医学和科学官兼主任Vinay Prasad博士表示:"今天的批准代表了精准医学的重大进步,基本上使患者的免疫系统成为治疗MZL的更有效工具。FDA持续优化监管,扩大治疗选择范围,以抗击癌症。"
边缘区淋巴瘤是一种罕见且生长缓慢的淋巴系统癌症。在B细胞非霍奇金淋巴瘤中约占7%,美国每年约有7,460例新发病例。边缘区淋巴瘤患者在接受前期治疗后治疗失败或复发后生存率降低。
美国食品药品监督管理局生物制品评价与研究中心治疗产品办公室代理主任Vijay Kumar博士表示:"今天的批准体现了FDA持续致力于推进细胞疗法以满足罕见癌症患者的需求。在批准时,FDA考虑了边缘区淋巴瘤患者在接受一次性治疗后显示出较高且持久的应答率,其中近一半的患者在诊断后两年内出现进展或患有难治性疾病。"
在一项针对成人复发或难治性边缘区淋巴瘤患者的开放标签、多中心、单臂试验中评估了Breyanzi的安全性和有效性,这些患者至少接受过两线或以上的全身治疗,或在造血干细胞移植(HSCT)后复发。研究参与者接受白细胞分离术,收集患者自身的免疫细胞以制造Breyanzi。患者在完成化疗后2至7天接受单剂量的Breyanzi,化疗是为了清除患者的淋巴细胞,即一种白细胞。在77例接受白细胞分离术的患者中,66例接受了研究指定的单次输注Breyanzi,其中95.5%的患者对治疗产生应答,62.1%的患者在影像学扫描中显示完全应答,无边缘区淋巴瘤迹象。在中位随访21.6个月后,应答是持久的。
最常见的不良反应是细胞因子释放综合征、腹泻、疲劳、肌肉骨骼疼痛和头痛。Breyanzi的完整处方信息可以在此查阅。
美国食品药品监督管理局已授予Breyanzi优先审评资格以及用于此申请的孤儿药认定。
美国食品药品监督管理局已授予Juno Therapeutics, Inc.Breyanzi的全面批准。
相关链接:https://www.drugfuture.com/fda/purplebookdata.aspx?BLANumber=125714&ProductNumber=001