近日,默沙东(MSD)宣布,其重磅肿瘤免疫疗法药物Keytruda已经获得了美国FDA的加速批准,将适应症扩大到局部晚期或转移性尿路上皮癌的一线治疗,造福那些无法使用顺铂化疗的患者。此外,FDA也同时批准Keytruda作为二线疗法,治疗罹患局部晚期或转移性尿路上皮癌,且经过含铂化疗,或是经过含铂化疗与辅助治疗/新辅助治疗的12个月内,病情依旧出现进展的患者。值得一提的是,Keytruda也是在针对“含铂治疗无效的晚期尿路上皮癌患者”这一群体中,首个总体生存率胜过化疗的抗PD-1疗法。
本次Keytruda所获的适应症尿路上皮癌是最为常见的膀胱癌类型,疾病病发于膀胱内部的尿道上皮细胞。据统计,它是全球第9大常见的癌症,仅在2013年全球就有近40万个尿路上皮癌新增病例和17.3万死亡病例。随着癌细胞不断增殖,肿瘤会扩散转移到身体的其他区域,而患者的生存率也随之骤降。数据显示,转移性的尿路上皮癌几乎是一种不治之症,5年总生存率不到15%。因此,在提高患者总生存率这一层面有着巨大的未满足医疗需求。
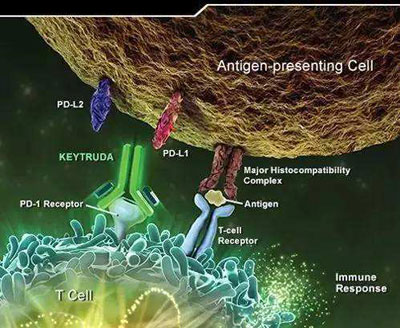
作为一款出色的抗PD-1抗体,由默沙东带来的Keytruda能抑制PD-1通路,从而激活人体的T细胞对肿瘤细胞进行杀伤。这款重磅肿瘤免疫疗法在多项癌症中展现出了出色的疗效,并已获批治疗黑色素瘤、头颈癌、非小细胞肺癌、以及经典霍奇金淋巴瘤。更多单药疗法与组合疗法的临床试验,也正在快速进展之中。
在一项名为KEYNOTE-052的多中心、公开标签、单臂临床试验中,研究人员评估了Keytruda在370名罹患局部晚期或转移性尿路上皮癌,却无法使用顺铂化疗的患者中的疗效。这些患者每3周接受200mg的Keytruda。研究发现,Keytruda在这群患者中的总体缓解率达到了29%(95% CI:24%,34%),完全缓解率为7%,部分缓解率为22%。基于这些数据,FDA批准Keytruda用于此类患者的一线治疗。
而在另一项名为KEYNOTE-045的多中心、随机、主动对照的临床试验中,研究人员招募了在含铂化疗治疗后病情依旧出现进展的局部晚期或转移性尿路上皮癌患者。这些患者被随机分为两组,一组患者每3周接受200mg的Keytruda治疗,另一组则每3周进行紫杉醇、多西紫杉醇、或长春氟宁化疗。研究表明,相比于化疗,Keytruda展现出了更为优异的总体生存率,且死亡风险降低了27%。去年10月,由于该试验的出色成果,独立的数据监控委员会决定提前终止试验,以让所有参与试验的患者都使用Keytruda进行治疗。这也奠定了本次FDA扩大适应症的基础。
“Keytruda现在能成为一线治疗方案,治疗那些无法采纳顺铂化疗等标准护理的晚期尿路上皮癌患者,”纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)的肿瘤学家Dean F. Bajorin博士说道:“作为二线疗法,Keytruda也能为晚期尿路上皮癌患者提供新的治疗方案。这也是唯一一个在3期临床试验中,总生存率超过化疗的抗PD-1疗法。”
“Keytruda获批治疗的癌症清单正在不断增长,这两项适应症则是清单上的重要补充。FDA的批准进一步彰显了默沙东的承诺,即帮助多种晚期癌症患者提高他们的生活质量。”默沙东研究实验室(Merck Research Laboratories)总裁Roger M. Perlmutter博士说。
我们祝贺Keytruda再次扩大适应症,也祝愿它能为更多癌症患者带来新的治疗希望。
参考资料:
[1] FDA Approves Merck’s KEYTRUDA® (pembrolizumab) for Certain Patients with Locally Advanced or Metastatic Urothelial Carcinoma, a Type of Bladder Cancer
[2] KEYTRUDA 膀胱癌3期成功!临床试验提前终止