丙肝巨头吉利德(Gilead)丙肝鸡尾酒Harvoni近日在美国监管方面再传喜讯,FDA已批准扩大Harvoni(ledipasvir/sofosbuvir)的适用人群,用于伴有晚期肝脏疾病的丙肝患者。具体而言,FDA已批准Harvoni联合利巴韦林(RBV)的12周治疗方案,用于:(1)无肝硬化或伴有代偿性肝硬化(Child-Pugh A)的基因型1或基因型4慢性丙型肝炎病毒(HCV GT-1,HCV GT-4)感染的肝移植受者;(2)伴有失代偿肝硬化(Child-Pugh B/C)的基因型1慢性丙型肝炎病毒(HCV GT-1)感染者,包括已开展肝移植术的患者。
这也使得Harvoni现在可用于更广泛的患者群体,包括:基因型1、4、5、6丙肝患者,HCV/HIV-1共感染者,基因型1/4丙肝肝移植受者,伴有失代偿肝硬化的基因型1丙肝患者。
此次批准对吉利德尤其重要,因为该批准赋予了Harvoni相对竞争对手艾伯维丙肝鸡尾酒Viekira Pak一个显著的竞争优势。去年10月,在收到数例Viekira Pak治疗伴有中重度肝硬化(Child-Pugh B & C)或肝纤维化丙肝患者导致肝功能衰竭及其他肝脏疾病的报告后,FDA发布安全性警告,Viekira Pak可能在伴有潜在肝脏疾病的群体中引发严重的肝损伤。该安全性警告触发了Viekira Pak处方标签的变化,尽管这一变化仅适用于约5%的丙肝群体,但仍导致艾伯维Viekira Pak在2015年第四季度的销售低于预期。
此次批准也非常关键,因为该批准扩大了吉利德最畅销药物Harvoni的患者群体,尽管是一个相对较小的比例,当仍足以实现额外的不菲收入。据估计,全球范围内有多达1.5亿丙肝患者,美国有320万例。根据美国疾病控制和预防中心(CDC)数据,高达20%的丙肝患者将发展为肝硬化。
在美国、欧洲和日本,丙肝所致肝硬化是肝移植的首要适应症。至少70%丙肝患者在肝移植3年内出现慢性肝脏疾病,大约20-30%丙肝患者会在肝移植5年内出现肝硬化。相较而言,在非肝移植患者群体中,丙肝感染至少20年时间才会出现肝硬化。另外,根据CDC数据,在美国有超过120万HIV感染者,大约30%合并感染HCV。
当前,Harvoni和Sovaldi的销售额占到了吉利德总销售额的60%以上,这也使得吉利德在未来的盈利将严重依赖这2种药物。根据吉利德的数据,Harvoni在2015年的全球销售额为138.6亿美元,吉利德预计今年的销售将持平,该公司将面临一个正在饱和的丙肝市场。此外,12周方案94500美元的高昂价格,也严重限制了Harvoni进入美国大多数州的健康计划。
另一方面,默沙东开发的丙肝鸡尾酒Zepatier近日也获得了FDA批准,售价较Harvoni低42%以上,这将再一次不可避免地在美国丙肝市场掀起一场激烈的价格战。业界预计,到2017年,Zepatier的市场份额将达到11%,将带来22亿美元的销售。
此次批准,是基于2个开放标签II期临床研究(SOLAR-1,SOLAR-2)的积极顶线数据。该研究在已接受肝移植术或伴有失代偿肝硬化的初治(treatment-naive)和经治(treatment-experienced)基因型1和基因型4丙肝患者中开展,评估了Harvoni联合利巴韦林(RBV)12周方案和24周方案的疗效和安全性。SOLAR-1和SOLAR-2研究中基因型1丙肝患者的汇总数据如下表所示:
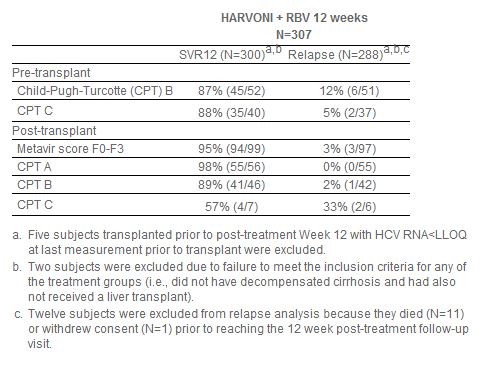
在无肝硬化或伴有代偿性肝硬化的基因型4丙肝肝移植后患者组(n=12)中的SVR12数据与基因型1丙肝的SVR12数据相似,无患者复发。伴有失代偿肝硬化(肝移植前和肝移植后)的基因型丙肝患者组中的数据不充分,不足以推荐剂量。SOLAR-1和SOLAR-2研究中12周方案治疗组共计7例患者伴有纤维化於胆性肝炎(FCH),这些患者均实现了SVR12。FCH是一种罕见、严重的复发型肝炎类型,之前尚无药物获批治疗FCH。